2
Objectifs
– Montrer qu’au cours d’une réaction chimique la matière se conserve.
– Écrire et équilibrer une équation bilan.
1. Notion de réaction chimique
1.1. Définition
Une réaction chimique est une transformation chimique au cours de laquelle les corps purs disparaissent et simultanément des corps purs nouveaux se forment.
Les corps purs qui disparaissent au cours d’une réaction chimique sont appelés les réactifs et les corps purs qui se forment sont appelés les produits.
Exemples
- Lors de la combustion du soufre, le soufre et le dioxygène disparaissent (réactifs) et il se forme du dioxyde de soufre (produit) qui est un gaz qui décolore une solution de permanganate de potassium de couleur violette.
- Lorsqu’on chauffe un mélange de fer (gris) et de soufre (jaune) en poudre, il se forme une nouvelle espèce chimique dans laquelle il n’est plus possible de séparer le fer du soufre : C’est du sulfure de fer(gris-noir).
1.2. Équation bilan de la réaction chimique
Les deux réactions peuvent être schématisées comme suit :
Soufre + dioxygène ——————-> dioxyde de soufre
Fer + soufre ——————-> sulfure de fer
En utilisant les formules des éléments chimiques, on obtient les équations bilans suivantes :
S + O2 ——————-> SO2 ;
Fe + S ——————-> FeS.
Une équation bilan est la représentation d’une réaction avec les formules des corps purs mis en jeu. Elle exprime les quantités de matières mis en jeu lors de la réaction.
En effet, les réactions ci-dessus se lisent :
- Une mole de soufre (S) réait avec une mole de dioxygène (O2) pour donner une mole de molécule de dioxyde de soufre (SO2).
- Une mole de fer (Fe) réagit avec une mole de soufre (S) pour donner une mole de sulfure de fer (FeS).
2. Conservation de la matière au cours d’une réaction chimique
- Au cours d’une réaction chimique, il y’a conservation des atomes.
Exemples
S + O2 ——————-> SO2 ;
Fe + S ——————-> FeS
H2 + 1/2 O2 ————> H2O soit 2H2 + O2 ————-> 2H2O.
Les coefficients 2, 1 et 1/2 sont appelés coefficients stœchiométriques. Ils sont placés devant la formule brute des corps pour traduire la conservation des atomes dans une équation bilan. L’équation bilan ainsi obtenue est dite équilibrée.
Remarque
Lorsque le coefficient est le chiffre 1, il n’est pas écrit.
- Au cours d’une réaction chimique, la masse des réactifs disparus est égale à celle des produits formés : C’est la loi de Lavoisier qui s’énonce comme suit :
« La masse des produits formés lors d’une réaction chimique est égale à la masse des réactifs consommés ».
Exercice d’application
Équilibrer les réactions suivantes :
Al + O2 ——————-> Al2O3
Cu2S + Cu2O ——————-> Cu + SO2
C + CO2 ——————-> CO
H2 + N2 ——————-> NH3
3. Électrolyse et synthèse de l’eau
3.1. Électrolyse de l’eau
L’électrolyse d’une substance est la décomposition de cette substance grâce au courant électrique. L’électrolyse est aussi une analyse. Analyser une substance c’est la décomposer en ses constituants.
Montage pour l’électrolyse de l’eau pure
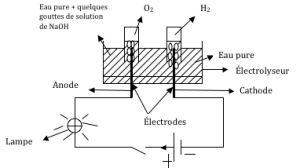
- 1er cas : Fermons l’interrupteur : Rien ne se passe.
Conclusion : l’eau pure ne conduit pas le courant électrique.
- 2ème cas : Versons dans l’électrolyseur quelques gouttes de solution de soude ou d’acide sulfurique, on observe les phénomènes suivants :
- La lampe brille.
- Des bulles de gaz se forment à la surface des électrodes.
- Le niveau de la solution dans les tubes baisse.
Interprétation :
La lampe brille parce que le mélange liquide (au +solution de soude ou eau + acide sulfurique) conduit le courant électrique. Ce mélange électrique est appelé électrolyte (solution qui conduit le courant électrique).
Le niveau de la solution baisse dans les tubes parce qu’une réaction chimique se produit au niveau des électrodes ; réaction libérant des bulles gazeuses.
L’analyse des gaz recueillis aux électrodes montre que le gaz recueilli à l’anode rallume une buchette d’allumette présentant un point rouge : C’est du dioxygène O2.
Le gaz recueilli à la cathode provoque une détonation en présence d’une flamme : C’est du dihydrogène H2.
L’expérience montre que, le volume du dihydrogène recueilli est le double de celui du dioxygène. VH2 = 2VO2↔ VO2 = 1VH2/2.
Conclusion.
Au cours de l’électrolyse de l’eau, l’eau disparait et simultanément il se forme du dihydrogène et du dioxygène. L’équation bilan qui s’écrit est:
H2O ——————-> H2 +1/2 O2 soit 2H2O ——————-> 2H2 + O2.
3.2. Synthèse de l’eau
La synthèse d’une substance est une transformation chimique au cours de la quelle la substance est formée à partir de ses constituant. L’équation bilan de la synthèse de l’eau s’écrit :
2H2 + O2 ——————-> 2H2O. C’est l’équation inverse de la synthèse de l’eau.
Montage pour la synthèse de l’eau :

